疯狂体育,疯狂体育app下载3年度 若手研究者学長表彰 疯狂体育,疯狂体育app下载報告
徳島大学大学院医歯薬学研究部呼吸器?膠原病内科学分野 講師 佐藤正大
線維細胞に着目した特発性肺線維症の病態解明と新規治療薬の開発
【研究グループ】
徳島大学大学院医歯薬学研究部呼吸器?膠原病内科学分野 医員 今倉健
徳島大学大学院医歯薬学研究部呼吸器?膠原病内科学分野 医員 山下雄也
徳島大学大学院医歯薬学研究部呼吸器?膠原病内科学分野 医員 村上行人
徳島大学大学院医歯薬学研究部呼吸器?膠原病内科学分野 医員 土師恵子
徳島大学大学院医歯薬学研究部地域リウマチ?総合内科学分野 特任助教 内藤伸仁
徳島大学大学院医歯薬学研究部呼吸器?膠原病内科学分野 助教 香川耕造
徳島大学病院呼吸器?膠原病内科 特任助教 小山壱也
徳島大学大学院医歯薬学研究部呼吸器?膠原病内科学分野 講師 佐藤正大
徳島大学大学院医歯薬学研究部地域リウマチ?総合内科学分野 特任准教授 河野弘
徳島大学大学院医歯薬学研究部呼吸器?膠原病内科学分野 教授 西岡安彦
【学術誌等への掲載状況】
- Sato S, Chong SG, Upagupta C, Yanagihara T, Saito T, Shimbori C, Belleye PS, Nishioka Y, Kolb M. The fibrotic extracellular matrix induces release of extracellular vesicles with pro-fibrotic miRNA from fibrocytes. Thorax: 76:895-906, 2021.
- Kawano H, Koyama K, Nishimura H, Toyoda Y, Kagawa K, Sato S, Naito N, Goto H, Inagaki Y, Nishioka Y. Development of improved method to identify and analyze lung fibrocytes with flow cytometry in a reporter mouse strain. Immun Inflamm Dis, 9:120-127, 2021.
- Morizumi S, Sato S, Koyama K, Okazaki H, Chen Y, Goto H, Kagawa K, Ogawa H, Nishimura H, Kawano H, Toyoda Y, Uehara H, Nishioka Y. Blockade of Pan-fibroblast Growth Factor Receptors Mediates Bidirectional Effects in Lung Fibrosis. Am J Respir Cell Moll Biol. 3:317-326, 2020.
- Abe S, Sato S, Aono Y, Azuma M, Kishi M, Koyama K, Takahashi N, Kagawa K, Kawano H, Nishioka Y. Functional analysis of human fibrocytes derived from monocytes reveals their profibrotic phenotype through paracrine effects. J Med Invest.67:102-112, 2020.
- Yanagihara T*, Sato S*, Upagupta C, Kolb M. What have we learned from basic science studies on idiopathic pulmonary fibrosis? Eur Respir Rev.28.pii:190029, 2019. *: Equal contribution
- Okazaki H, Sato S, Koyama K, Morizumi S, Abe S, Azuma M, Chen Y, Goto H, Aono Y, Ogawa H, Kagawa K, Nishimura H, Kawano H, Toyoda Y, Uehara H, Kouji H, Nishioka Y. The novel inhibitor PRI-724 for Wnt/β-catenin/CBP signaling ameliorates bleomycin-induced pulmonary fibrosis in mice. Exp Lung Res. 45:188-199, 2019.
- Kishi M, Aono Y, Sato S, Koyama K, Azuma M, Abe S, Kawano H, Kishi J, Toyoda Y, Okazaki H, Ogawa H, Uehara H, Nishioka Y.Blockade of platelet-derived growth factor receptor-β, not receptor-α ameliorates bleomycin-induced pulmonary fibrosis in mice. PLOS ONE. 13: e0209786, 2018.
- Koyama K, Goto H, Morizumi S, Kagawa K, Nishimura H, Sato S, Kawano H, Toyoda Y, Ogawa H, Homma S, Nishioka Y. The Tyrosine Kinase Inhibitor TAS-115 Attenuates Bleomycin-induced Lung Fibrosis in Mice. Am J Respir Cell Mol Biol. 60:478-487, 2019.
- Sato S, Shinohara S, Hayashi S, Morizumi S, Abe S, Okazaki H, Chen Y, Goto H, Aono Y, Ogawa H, Koyama K, Nishimura H, Kawano H, Toyoda Y, Uehara H, Nishioka Y. Anti-fibrotic efficacy of nintedanib in pulmonary fibrosis via the inhibition of fibrocyte activity. Respir Res. 18:172, 2017.
- Toyoda Y, Hanibuchi M, Kishi J, Kawano H, Morizumi S, Sato S, Kondo M, Takikura T, Tezuka T, Goto H, Nishioka Y. Clinical features and outcome of acute exacerbation of interstitial pneumonia associated with connective tissue disease. J Med Invest. 63:294-299, 2016.
特発性肺線維症は原因不明の慢性肺線維化疾患で、難病指定を受けている予後不良の呼吸器疾患です。現在、特発性肺線維症の治療には2種類の抗線維化薬が認可されていますが、期待されるのは慢性的な呼吸機能の低下の抑制に留まるなど、未だ限定的な治療効果しか見込めないのが実情です。そのため更なる治療効果の向上のため、新たな治療標的分子の発見や新規治療薬の開発が求められています。このような背景から、我々の研究グループは、特発性肺線維症の細胞分子病態の解析と創薬への応用を目指した研究を進めてきました。
特発性肺線維症の病態生理の特徴として、肺線維芽細胞の異常増殖による線維化の進行があげられます。しかしその肺線維芽細胞の異常増殖を引き起こすメカニズムは、未だ完全には解明されていません。
私たちの研究の結果、線維化した肺組織では、単球由来の間葉系前駆細胞である「線維細胞」という細胞が、多量の増殖因子を分泌することで、線維芽細胞に増殖刺激を与えていることが分かりました。更に我々は、現在、特発性肺線維症の治療に使用されている抗線維化薬の1つであるニンテダニブ(オフェブ®)は、線維細胞の機能を修飾することで抗線維化作用を発揮しているという新たな分子メカニズムをも見出しています(Sato S, et al. Respir Res, 2017)。
次に、線維細胞が分泌する、増殖因子以外の線維化促進因子ついて研究を行いました。その結果、線維細胞は線維化した肺組織の異常な組織構造の影響を受けて、線維化促進性マイクロRNAであるmiR-21の発現量を変化させ、線維化を促進しているという新たなメカニズムが見出されました(Sato S, et al. Thorax. 2021)。この線維細胞におけるマイクロRNAの発現は、実際の特発性肺線維症の患者さんの気管支肺胞洗浄液中から単離した線維細胞を用いた検討でも確認されました。
このように、線維細胞は様々な傍分泌因子を介して肺線維芽細胞に影響を与えることで肺の線維化を促進しており、特発性肺線維症の治療標的になりえる細胞種であることが明らかになりました。
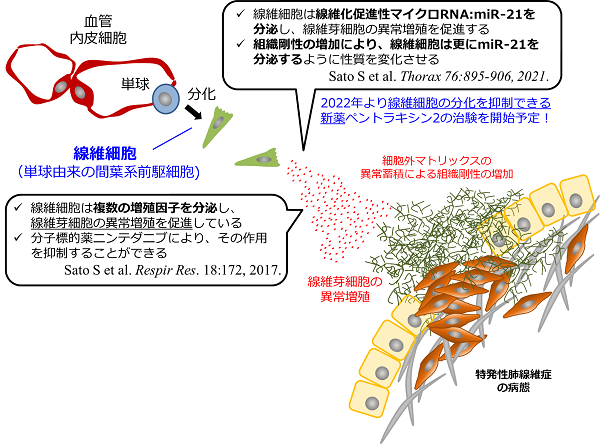
2018年に線維細胞の分化抑制作用を有するペントラキシン2による治療は、特発性肺線維症の患者さんの肺機能減少を抑制しえるとした第Ⅱ相臨床試験結果が発表され、線維細胞は新たな治療標的候補として大きな注目を集めています。特発性肺線維症の患者さんに対するペントラキシン2の第Ⅲ相無作為化二重盲検プラセボ対照試験も、まもなく開始されようとしています(2022年1月時点)。
このように、今後、線維細胞を標的とした戦略が、新たな特発性肺線維症の治療に組み込まれていくことが期待されています。我々は線維細胞に着目した基礎研究を継続することで、特発性肺線維症の分子メカニズムを解明し、更なる治療薬開発に結びつけていきたいと考えています。







